Equation de réaction acide base CHIMIE TERMINALE YouTube
On raisonnera comme pour l’acide totalement dissocié dans l’eau, on considèrera que la base dosée est OH-(aq) et on utilisera une solution d’acide chlorhydrique pour effectuer ce dosage. d. 4ème cas : on veut titrer une base dont la dissociation est limitée dans l’eau :. Réaction acido-basique et couples acide-base La réaction a lieu entre deux couples acide-base. L’acide du couple 1 réagit avec la base du couple 2 et les produits de la transformation sont la.

Chapitre 17 Les acides et les bases Cours de chimie générale
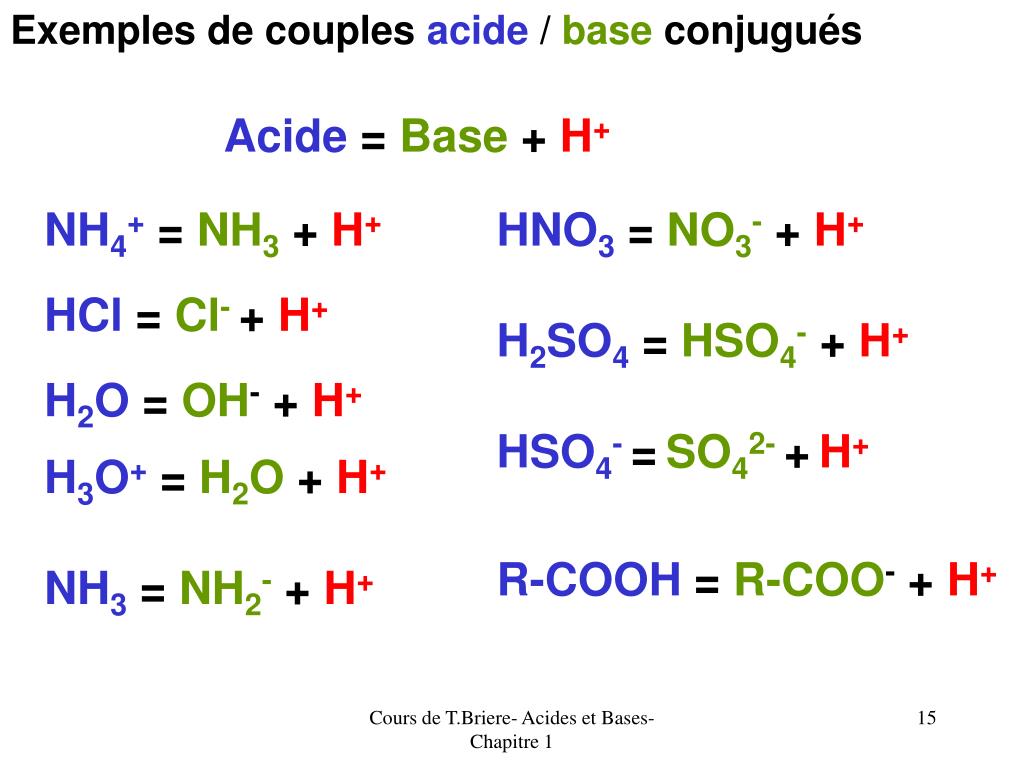
PPT ACIDES ET BASES PowerPoint Presentation, free download ID3849647

Schéma de LEWIS couple ACIDE / BASE CHIMIE TERMINALE YouTube
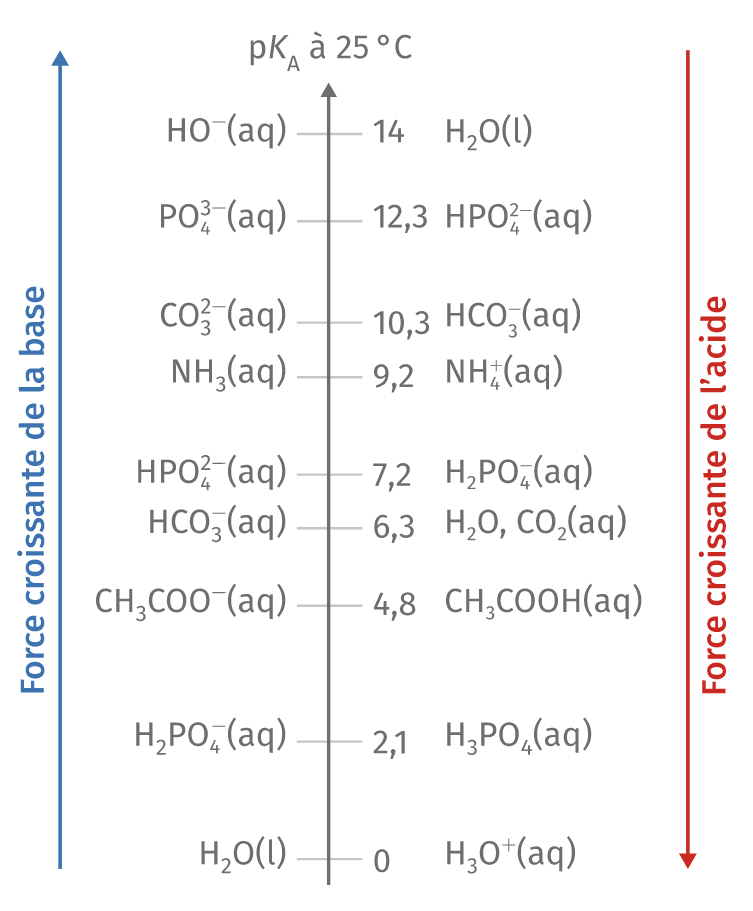
Force des acides et des bases Evolution spontanée d’un système chimique

Les réactions acidobasiques Résumé de cours 1 AlloSchool

Acidebase (couple et demiéquation) Terminale Chimie YouTube

Equation de réaction acide base CHIMIE TERMINALE YouTube

Équation de réaction acide base ️ Exercice Terminale Chimie YouTube

Couples acide/Base Diagrammes de prédominance et de distribution YouTube

Transformations acidobasiques(1). Équations de réactions. YouTube

Couples acide base YouTube

1Formation Théorie acidobasique

Transformations liées à des réactions acidebase Cours 2 AlloSchool
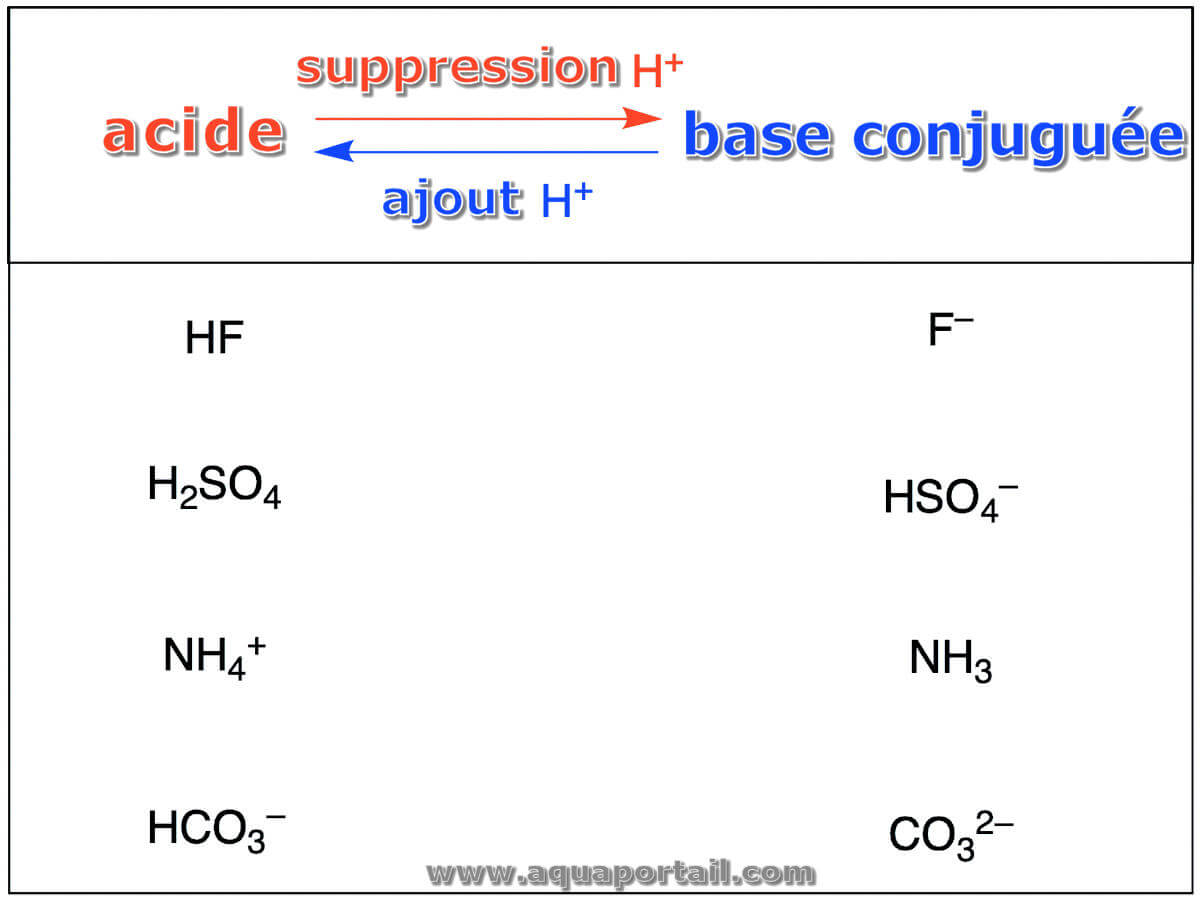
Base conjuguée définition et explications

Réactions de quelques métaux avec les solutions acides et basiques Cours 5 AlloSchool
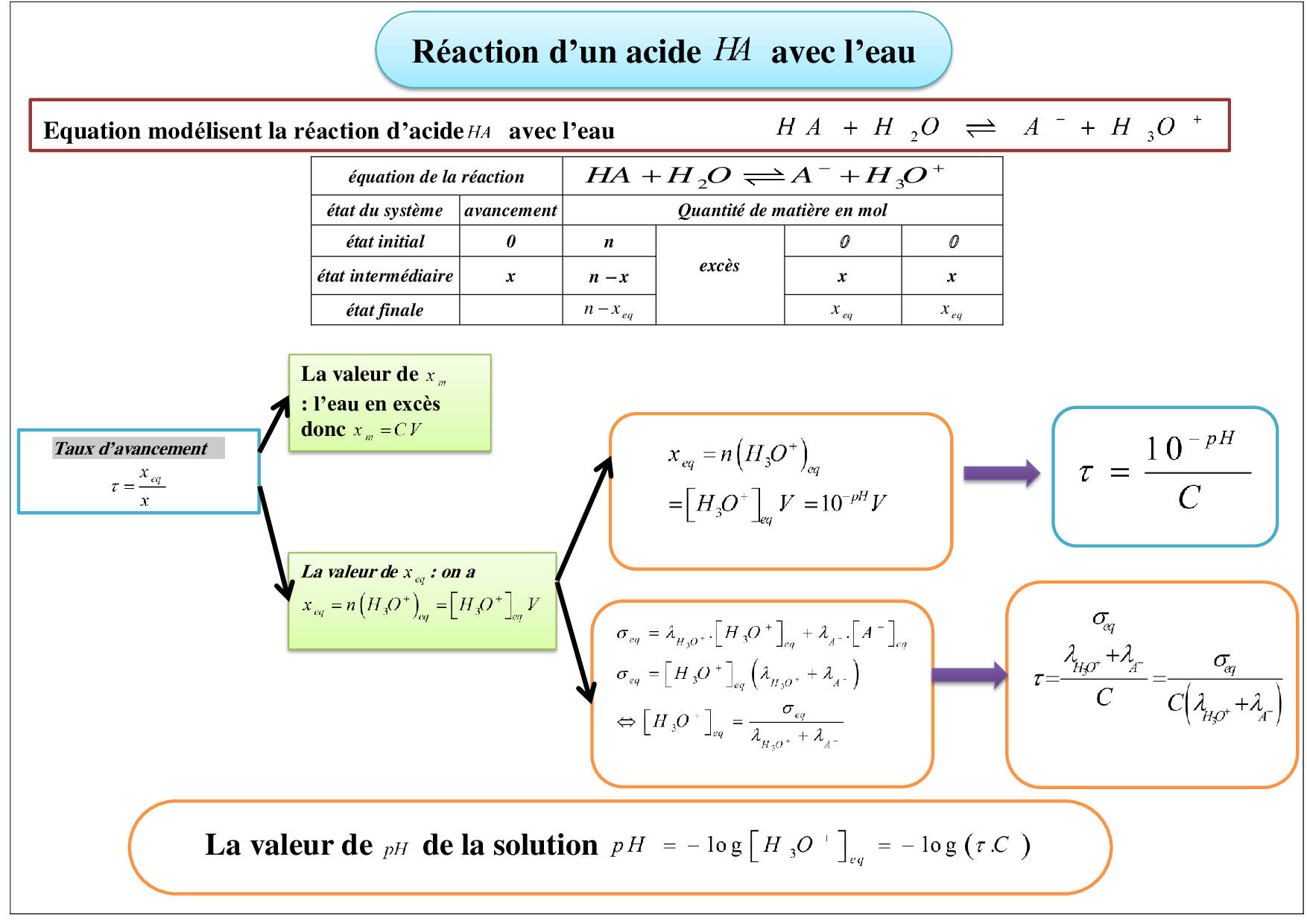
Transformations liées à des réactions acidebase Cours 2 AlloSchool
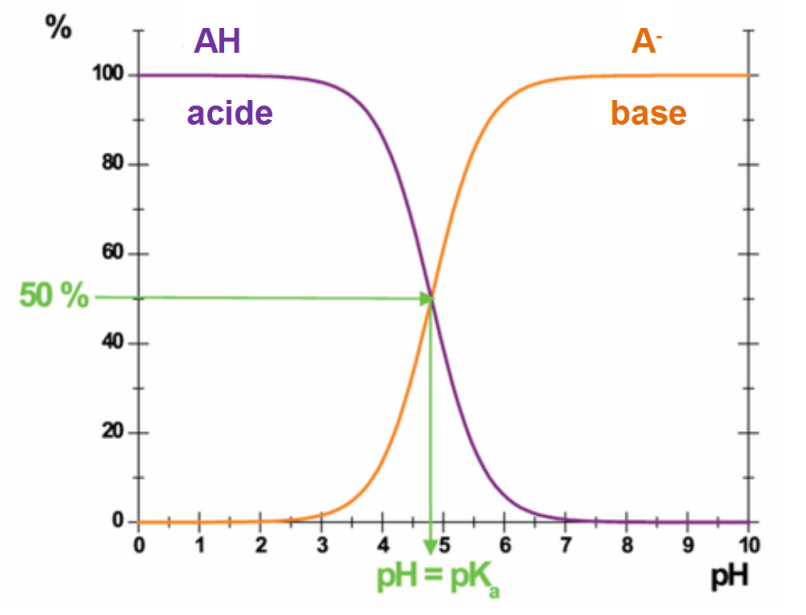
Solutions aqueuses et dosage Diagramme de distribution d’espèces acidobasiques en fonction du pH

Force des acides et des bases échelle de pKa YouTube

Les solutions acides et basiques Cours 1 AlloSchool

Chimie en solution Les acides et les bases YouTube
Enoncé du baccalauréat 1986 – Couples acides base. 1) On mélange 20 cm 3 d’une solution d’ acide chlorhydrique de concentration molaire 0,1 mol/L et 40 cm 3 d’une solution d’éthanoate de sodium de concentration molaire 0,1 mol/L. Le pH du mélange obtenu est 4,8. a) Calculer les concentrations molaires des diverses espèces chimiques.. L’acide éthanoïque appelé couramment acide acétique appartient au couple acide/base CH3COOH(aq) / CH3COO-(aq) où l’ion éthanoate, appelé souvent ion acétate, de formule CH3COO-(aq) , est la base conjuguée de l’acide éthanoïque. La demi-équation correspondante est : CH3COOH(aq) = CH3COO-(aq) + H + .


